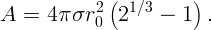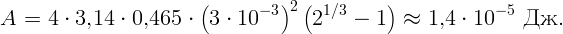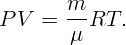
Плотность алюминия 2,7 ⋅ 103 кг/м3. Сколько атомов алюминия содержится в объеме 1 см3? Молекулярная масса алюминия 27 ⋅ 10-3 кг/моль.
Решение
Один моль (27 г) алюминия содержит 6 ⋅ 1023 атомов. В 1 см3 содержится 2,7 г, то есть в 10 раз меньше.
Ответ: 6 ⋅ 1022 атомов.
Найдите формулу соединения азота с кислородом, если его масса m = 1 г в газообразном состоянии в объеме V = 1 л создает при температуре T = 17∘C давление P = 3,17 ⋅ 104 Па.
Решение
Давление определяется из уравнения состояния идеального газа
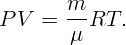
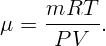
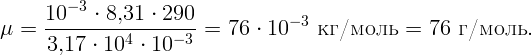
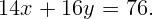
Ответ: соединение N2O3.
Температура воздуха в комнате объемом V = 45 м3 повысилась от t1 = 17∘C до t2 = 27∘C. На сколько уменьшилась масса воздуха в комнате? Атмосферное давление P0 = 105 Па постоянно. Молекулярная масса воздуха μ = 29 г/моль.
Решение
Пусть m1 масса воздуха, соответствующая начальной температуре T1 = 290 K, а m2 – конечной T2 = 300 K. Запишем уравнения состояния газа для начального и конечного состояний:
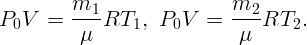
Выражая массы из первых двух уравнений и подставляя в третье, получим
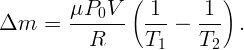
Во сколько раз изменится подъемная сила воздушного шара, если наполняющий его гелий заменить водородом? Весом оболочки шара пренебречь.
Решение
Пусть атмосферное давление P, температура T, объем воздушного шара V . Масса воздуха, содержащаяся при этих условиях в объеме V , определится из уравнения состояния
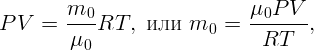
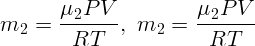
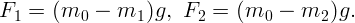
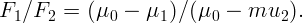
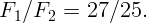
Одноатомный идеальный газ изотермически расширяется из состояния с давлением P = 105 Па от объема V 1 = 1 м3 до объема V 2 = 5 м3. Какова внутренняя энергия и давление газа в конечном состоянии?
Решение
Внутренняя энергия идеального газа при изотермическом расширении не меняется. Поэтому ее можно найти из начального состояния. Для одноатомного газа
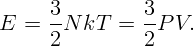
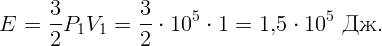
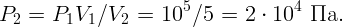
Газ в цилиндре получил тепло Q = 1000 Дж и, расширившись, совершил работу A = 300 Дж. На сколько изменилась при этом его внутренняя энергия?
Решение
Согласно первому закону термодинамики изменение внутренней энергии газа равно количеству тепла, полученного газом, минус работа, совершенная газом: ΔE = Q - ΔA.
Откуда ΔE = 1000 - 300 = 700 Дж.
Один моль одноатомного идеального газа участвует в циклическом процессе, график которого, состоящий из двух изохор и двух изобар, представлен на рисунке 2.1. Температуры в точках 1 и 3 равны T1 и T3. Известно, что точки 2 и 4 лежат на одной изотерме. Определите работу, совершенную газом за цикл и КПД цикла.
Решение
Обозначим через V 1 минимальный объем, занимаемый газом (на изохоре 1,2), через V 2 – максимальный (на изохоре 3,4). Соответственно, через P1 – минимальное (на изобаре 4,1), а через P2 – максимальное (на изобаре 2,3) давление. Пусть температура в точках 2 и 3 равна T2.
Работа газа за цикл определится как площадь на диаграмме:
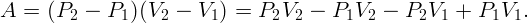 | (2.1) |
Из уравнения состояния идеального газа для одного моля имеем:
Подставляя (2.2) – (2.5) в (2.1), получим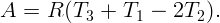
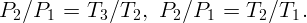
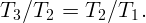
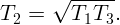
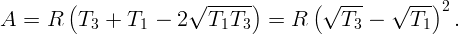
При изохорическом процессе тепло, полученное газом:
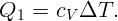
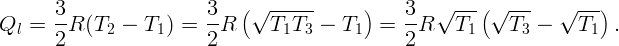
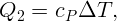
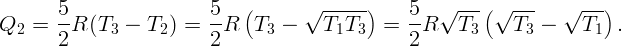
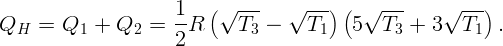
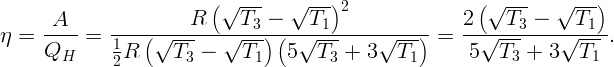
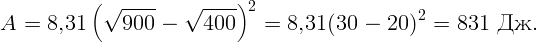
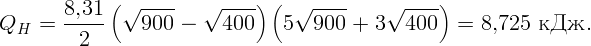
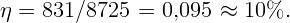
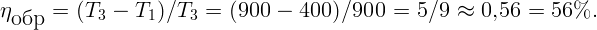
С помощью электрической плитки мощностью N = 1 кВт в комнате поддерживается температура воздуха t1 = 17∘C при температуре наружного воздуха t2 = -23∘C. Какая мощность потребовалась бы для поддержания в комнате той же температуры с помощью обратимой тепловой машины?
Решение
Для поддержания нужной температуры запустим тепловую машину по обратному циклу. Тогда наружный воздух будет играть роль нагревателя при T2 = 250 K, а воздух в комнате – роль холодильника при T1 = 290 K. Процесс пойдет таким образом: забрав тепло Q2 от наружного воздуха и затратив некоторую работу A (например, с помощью электродвигателя), передадим тепло Q1 внутрь комнаты. Пусть A, Q1 и Q2 относятся к единице времени (секунде). Тогда для поддержания той же температуры необходимо, чтобы переданное тепло Q1 равнялось теплу, поступающему в первом случае:
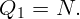
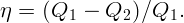
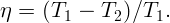
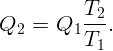
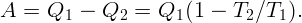
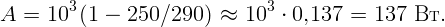
В кастрюлю налили воду при температуре t0 = 10∘C и поставили на плиту. Через τ = 10 минут вода закипела. Через какое время она полностью превратится в пар?
Решение
Обозначим через c удельную теплоемкость воды. Будем считать, что теплоемкость при росте температуры не меняется: c = 1 кал/(г⋅град) = 4,18 ⋅ 103 Дж/(кг⋅град).
Пренебрежем потерями тепла, считая, что за единицу времени при любой температуре воде передается одинаковая энергия w. Пусть масса воды m. Тогда за время τ вода получила энергию wτ, которая пошла на нагревание до температуры кипения t = 100∘ C:
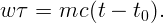 | (2.1) |
Для того, чтобы вода выкипела, она должна получить энергию mq, где q = 2,26 ⋅ 106 Дж/кг – удельная теплота парообразования воды. Такое тепло вода получит за время τ1:
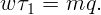 | (2.2) |
Выразив массу из (2.1) и подставив в (2.2) получаем
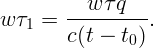
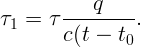
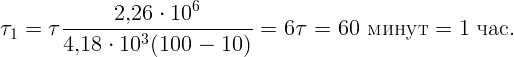
Ответ: вода полностью выкипит через час после закипания.
В стакан налиты две несмешивающихся жидкости: четыреххлористый углерод (CCl4) и вода. При нормальном атмосферном давлении CCl4 кипит при 76,7∘C, вода – при 100∘C. При равномерном нагревании стакана со смесью в водяной бане кипение на границе раздела жидкостей начинается при температуре 65,5∘С. Определите, какая из жидкостей быстрее (по массе) выкипает при таком «пограничном» кипении и во сколько раз. Давление насыщенного пара воды при 65,5∘С составляет 25,6 кПа.
Решение
При пограничном кипении газовые пузырьки растут на границе раздела жидкостей. При этом сумма парциальных давлений CCl4 (P1) и воды (P2 = 25,6 кПа) должна равняться атмосферному давлению (при нормальных условиях P0 = 1 атм = 100 кПа):
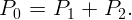 | (2.1) |
Масса m1 четыреххлористого углерода, находящегося в некотором пузырьке объема V , определится из уравнения Клапейрона-Менделеева:
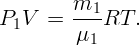 | (2.2) |
Здесь μ1 = 154 г/моль – молекулярная масса CCl4, T = 338,5 K – абсолютная температура, соответствующая 65,5∘C. Аналогично для воды
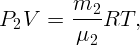 | (2.3) |
где μ2 = 18 г/моль.
Разделив почленно (2.2) на (2.3), имеем
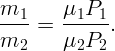 | (2.4) |
Подставив в (2.4) давление P1, выраженное из (2.1), получим
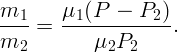
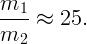
При одинаковой температуре смешали (объединив объемы) V 1 = 1 м3 воздуха влажностью φ1 = 20% и V 2 = 2 м3 воздуха влажностью φ2 = 30%. Определите относительную влажность смеси.
Решение
Обозначим давление насыщенного пара при температуре T через P0, парциальное давление водяного пара массы m1 в объеме V 1 = 1 м3 – через P1, а водяного пара массы m2 в объеме V 2 = 2 м3 – через P2.
По определению влажность (выраженная не в процентах) в первом объеме
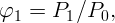 | (2.1) |
а во втором
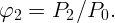 | (2.2) |
Параметры водяного пара в каждом случае определятся из уравнения Клапейрона-Менделеева
После объединения объемов установится парциальное давление водяного пара P, определяемое из уравнения
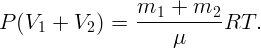 | (2.5) |
Выразив из (2.1) и (2.2) P1 = φ1P0 и P2 = φ2P0, а также m1 и m2 из (2.3) и (2.4) и подставив все в (2.5), получим
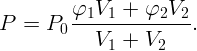
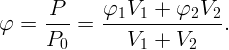
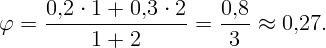
Какую работу против сил поверхностного натяжения нужно совершить, чтобы разделить сферическую каплю ртути радиуса r0 = 3 мм на две одинаковые капли? Коэффициент поверхностного натяжения ртути σ = 0,465 Н/м.
Решение
Работа против сил поверхностного натяжения определяется изменением полной поверхности
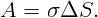 | (2.1) |
Начальная поверхность S0 = 4πr02. Обозначим радиус каждой из двух образовавшихся капель через r. Тогда полная поверхность двух капель S = 2 ⋅ 4πr2. Так как ΔS = S - S0, работа
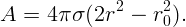 | (2.2) |
При разделении капли сохраняется полный объем ртути
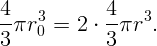 | (2.3) |
Откуда находится радиус образовавшихся капель. Подставив r из (2.3) в (2.2), получим